https://www.google.com/calendar/embed?src=c9ccnubmnpl3qmsr7j2tr0f0b0%40group.calendar.google.com&ctz=America/Bogota CALENDARIO
jueves, 14 de junio de 2012
Alqueno
Los alquenos u olefinas son hidrocarburos insaturados que tienen uno o varios dobles enlaces carbono-carbono en su molécula. Se puede decir que un alqueno no es más que un alcano que ha perdido dos átomos de hidrógeno produciendo como resultado un enlace doble entre dos carbonos. Los alquenos cíclicos reciben el nombre de cicloalquenos.
Formulación y nomenclatura de alquenos
La fórmula general de un alqueno de cadena abierta con un sólo doble enlace es CnH2n. Por cada doble enlace adicional habrá dos átomos de hidrógeno menos de los indicados en dicha fórmula.
| Fórmula | Recomendaciones IUPAC-1979 | Recomendaciones IUPAC-19931 2 |
|---|---|---|
| localizador - prefijo de número átomos C (acabado en -eno) | prefijo de número átomos C - localizador -eno | |
| CH3-CH2-CH=CH2 | 1-buteno | but-1-eno |
Propiedades físicas
a presencia del doble enlace modifica ligeramente las propiedades físicas de los alquenos frente a los alcanos.
De ellas, la temperatura de ebullición es la que menos se modifica. La
presencia del doble enlace se nota más en aspectos como la polaridad y
la acidez.
Polaridad
Dependiendo de la estructura, puede aparecer un momento dipolar débil.El enlace alquilo-alquenilo está polarizado en la dirección del átomo con orbital sp2, ya que la componente s de un orbital sp2 es mayor que en un sp3 (esto podría interpretarse como la proporción de s a p en la molécula, siendo 1:2 en sp2 y 1:3 en sp3, aunque dicha idea es simplemente intuitiva). Esto es debido a que los electrones situados en orbitales híbridos con mayor componente s están más ligados al núcleo que los p, por tanto el orbital sp2 es ligeramente atrayente de electrones y aparece una polarización neta hacia él. Una vez que tenemos polaridad en el enlace neta, la geometría de la molécula debe permitir que aparezca un momento dipolar neto en la molécula, como se aprecia en la figura inferior.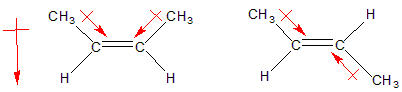
Reacciones de los alcanos Los alcanos por lo general no se consideran sustancias muy reactivas. Sin embargo, en condiciones adecuadas pueden llevar a cabo diversas tipos de reacciones, incluyendo la combustión. El quemado del gas natural, de la gasolina y del petróleo implica la combustión de los alcanos. Todas estas reacciones son altaríiente exotérinicas:
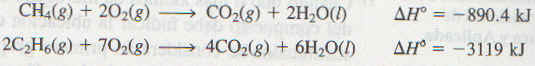 |
 |
 |
 |
Hidrocarburos Saturados
Alcanos
Son
hidrocarburos lineales con todos sus enlaces simples, por lo que se les
denomina hidrocarburos saturados. Se nombran anteponiendo un prefijo
griego que indica el número de átomos de carbono a la terminación -ano. Los primeros de la serie son: (Los siguientes llevan por nombre pentano, hexano y heptano, octano, nonano y decano).
Metano: CH4
Etano: CH3-CH3
Propano: CH3-CH2-CH3
Butano: CH3-CH2-CH2-CH3
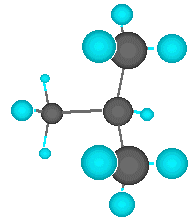
Aquí tienes el
dibujo (estático) y la simulación (dinámica) de la molécula de butano.
Como puedes apreciar en la simulación, girando la molécula con el ratón,
las cadenas carbonadas no son exactamente lineales, en realidad tienen
un trazado en zig-zag en las tres dimensiones espaciales. Etano: CH3-CH3
Propano: CH3-CH2-CH3
Butano: CH3-CH2-CH2-CH3
También
existen en la Naturaleza hidrocarburos ramificados, que se nombran
dando a los sustituyentes el nombre del prefijo numércio griego acabado
en -il, seguido por el nombre de la cadena principal.
Un ejemplo de ellos son el metilpropano, y el metilbutano. Aquí tienes
sus simulaciones para que las muevas y gires en el espacio
| |
Las
cadenas ramificadas pueden dar lugar a la isomería de cadena. Consiste
en que dos compuestos tienen la misma fórmula molecular pero distinta
fórmula estructural lo que implica propiedades físicas y químicas
distintas. Por ejemplo el metilpropano y el butano son isómeros. Ambos
tienen la misma fórmula molecular C4H10 pero distintas fórmulas estructurales, CH3-CH(CH3)-CH3 y CH3-CH2-CH2-CH3.
|
|
 |
 |
| omenclatura de alcanos |

|

|

Ácido barbitúrico
El ácido barbitúrico fue descubierto por el químico alemán Adolf von Baeyer, en 1864. Se especula que le dio este nombre en honor de una amiga llamada bárbara. La ciencia química fue avanzando y el gran número de compuestos orgánicos descubiertos hicieron imprescindible el uso de una nomenclatura sistemática. En el sistema IUPAC de nomenclatura un nombre está formado por tres partes: prefijos, principal y sufijos; Los prefijos indican los sustituyentes de la molécula; el sufijo indica el grupo funcional de la molécula; y la parte principal el número de carbonos que posee. Los alcanos se pueden nombrar siguiendo siete etapas: Regla 1.- Determinar el número de carbonos de la cadena más larga, llamada cadena principal del alcano. Obsérvese en las figuras que no siempre es la cadena horizontal.  El nombre del alcano se termina en el nombre de la cadena principal (octano) y va precedido por los sustituyentes. Regla 2.- Los sustituyentes se nombran cambiando la terminación –ano del alcano del cual derivan por –ilo (metilo, etilo, propilo, butilo). En el nombre del alcano, los sustituyentes preceden al nombre de la cadena principal y se acompañan de un localizador que indica su posición dentro de la cadena principal. La numeración de la cadena principal se realiza de modo que al sustituyente se le asigne el localizador más bajo posible.  |

Si varios sustituyentes son iguales, se emplean los prefijos di, tri, tetra, penta, hexa, para indicar el número de veces que aparece cada sustituyente en la molécula. Los localizadores se separan por comas y debe haber tantos como sustituyentes.

Los prefijos de cantidad no se tienen en cuenta al ordenar alfabéticamente.
Regla 4.- Si al numerar la cadena principal por ambos extremos, nos encontramos a la misma distancia con los primeros sustituyentes, nos fijamos en los demás sustituyentes y numeramos para que tomen los menores localizadores.

Regla 5.- Si al numerar en ambas direcciones se obtienen los mismos localizadores, se asigna el localizador más bajo al sustituyente que va primero en el orden alfabético.
Regla 6.- Si dos a más cadenas tienen igual longitud, se toma como principal la que tiene mayor número de sustituyentes.

Regla 7.- Existen algunos sustituyentes con nombres comunes aceptados por la IUPAC, aunque se recomienda el uso de la nomenclatura sistemática.

Los nombres sistemáticos de estos sustituyentes se obtienen numerando la cadena comenzando por el carbono que se une a la principal. El nombre del sustituyente se forma con el nombre de la cadena más larga terminada en –ilo, anteponiendo los nombres de los sustituyentes que tenga dicha cadena secundaria ordenados alfabéticamente. Veamos un ejemplo:

Suscribirse a:
Entradas (Atom)







